EGFR E LA SUA DISREGOLAZIONE NEL NSCLC

IL RUOLO DELL'EGFR NEL NSCLC
Le mutazioni dell’EGFR alterano la funzione dell’EGFR e sono il secondo driver oncogenico più comune nel NSCLC
L’EGFR wild-type è una proteina della superficie cellulare che regola molti processi cellulari2,3
L’EGFR è un recettore tirosin-chinasico, membro della famiglia ERBB, che regola le vie di segnalazione che controllano la crescita, la motilità e la sopravvivenza delle cellule (fig. 1).4
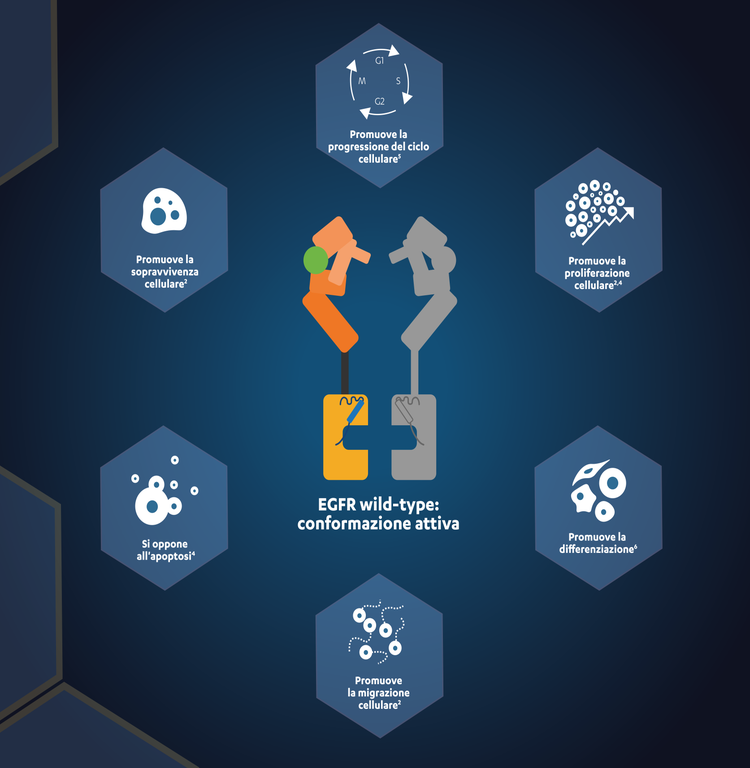
Figura 1. Funzioni endogene dell’EGFR wild-type attivo.
L’EGFR è codificato dagli esoni del gene EGFR, localizzato sul cromosoma 7 in posizione 12.4
La proteina EGFR si trova in uno stato inattivo, ma il legame del ligando alla sua porzione extracellulare porta all’attivazione del recettore.² Questo porta
all’omo-dimerizzazione del recettore (dove due monomeri di EGFR si uniscono) o all’etero-dimerizzazione (dove un monomero di EGFR si unisce con un diverso
partner di dimerizzazione).2,4 In seguito l’ATP può legarsi al dominio tirosin-chinasico sul lato citoplasmatico dell’EGFR, portando alla fosforilazione del recettore e
all’attivazione della segnalazione a valle attraverso pathway come PI3K/AKT/mTOR e RAS/RAF/MAPK (fig. 2).2,4
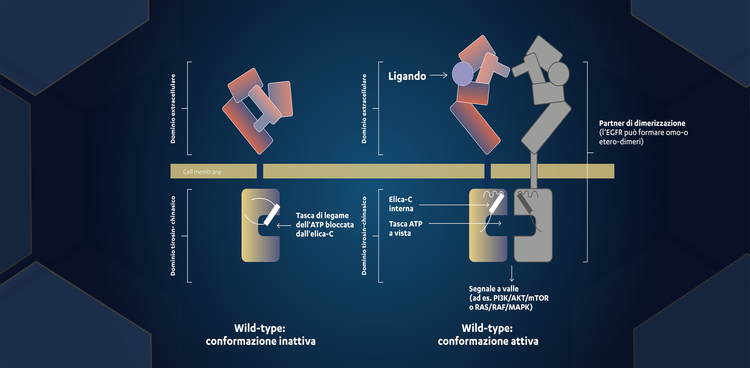
Figura 2. Attivazione dell’EGFR wild-type mediante legame del ligando
Conformazione inattiva: in assenza di un ligando, il recettore EGFR è inattivo. La tasca di legame dell’ATP è bloccata dall’elica-C.1
Conformazione attiva: il legame del ligando alla porzione extracellulare del recettore porta ad un cambiamento conformazionale. L’elica-C ruota da una
conformazione “verso l’esterno” inattiva a una conformazione “interna” attiva, che espone la tasca di legame dell’ATP.2
Adattato da Fig. 3 di Rif. 2 e da Fig. 4 di Rif. 7.
L’attivazione costitutiva della segnalazione dell’EGFR, tramite una mutazione nell’EGFR o in uno dei suoi componenti di segnalazione a valle (ad es. KRAS), può portare a un’eccessiva proliferazione, sopravvivenza e migrazione, guidando il NSCLC.5


Le alterazioni del gene EGFR svolgono un ruolo critico nella guida del NSCLC3
La disregolazione dell’EGFR guida il NSCLC: un segnale in eccesso può causare proliferazione cellulare, angiogenesi, invasione e metastasi.3
Ci sono due circostanze in cui un EGFR alterato può determinare un eccesso di segnalazione:
Sovraespressione di EGFR – osservata nel 40–89% di tutti i NSCLC ed è associata a una prognosi sfavorevole.3,4
Mutazioni dell’EGFR (EGFRm) - osservate in circa il 13% di tutti i NSCLC in Europa, con una frequenza più alta in Asia (~49%).9
Molte mutazioni dell’EGFR determinano l’attivazione costitutiva dell’EGFR (il recettore è sempre “acceso”) anche in assenza di un ligando, guidando crescita e sopravvivenza del tumore.4 Le mutazioni dell’EGFR riscontrate nel NSCLC includono delezioni nell’esone 19, sostituzioni/mutazioni puntiformi (ad es. L858R Esone 21, T790M Esone 20) e mutazioni ex20ins.1

Scopri di più sulle mutazioni da inserzione nell’esone 20 dell’EGFR:
AKT: proteina chinasi B; ALK: chinasi del linfoma anaplastico; ATP: adenosina trifosfato; EGFR: recettore del fattore di crescita dell’epidermide; ERBB: recettori per il fattore di crescita epiteliale; ex20ins: inserzione nell’esone 20; KRAS: proto-oncogene omologo dell’oncogene virale del sarcoma del ratto di Kirsten; MAPK: proteina chinasi attivata da mitogeno; mTOR: bersaglio meccanicistico della rapamicina; NSCLC: carcinoma polmonare non a piccole cellule; PI3K: fosfoinositide 3-chinasi; RAF: rapidly accelerated fibrosarcoma; RAS: rat sarcoma.
Bibliografia
- Harrison et al. Semin Cancer Biol 2020; 61: 167–179.
- Vyse S et al. Signal Transduct Target Ther 2019; 4: 5.
- Prabhakar C et al. Transl Lung Cancer Res 2015; 4(2): 110–118.
- Villalobos P and Wistuba I. Hematol Oncol Clin North Am 2017; 31(1): 13–29.
- Wee P and Wang Z. Cancers 2017; 9(52): 1–45.
- Sabbah D et al. Curr Top Med Chem 2020; 20: 1–20.
- Ferguson K et al. Mol Cell 2003; 11(2): 507–517.
- ESMO clinical practice guidelines. Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Updated version published 15 September 2020.
- Melosky B et al. Poster presentation presented at the IASLC 2020 World Conference on Lung Cancer. 28–31 January 2021. Singapore, worldwide virtual event. P37.17.